Notimex
El Universal
Ciudad de México
Domingo 30 de diciembre de 2007
Investigadoras de la Universidad Autónoma Metropolitana (UAM) identificaron que en cultivos primarios la sobreexpresión de la proteína Bcl-2 induce la senescencia celular prematura, lo que se ha asociado al envejecimiento.
Norma Edith López Díaz Guerrero y Mina Konigsberg Fainstein, responsable y asesora del trabajo, respectivamente, señalaron que su labor contribuye al conocimiento de la senescencia celular y su papel en el envejecimiento, así como en enfermedades relacionadas, como el cáncer.
En un comunicado, indicaron que si se comprenden los mecanismos que generan el deterioro asociado al envejecimiento, éste puede detenerse y lograr que la gente llegue en mejores condiciones de vida a una edad avanzada.
Ello, sobre todo cuando se calcula que para el año 2050 uno de cada cuatro mexicanos tendrá más de 65 años, destacaron las investigadoras de la Unidad Iztapalapa.
El estudio del Laboratorio de Bioenergética y Envejecimiento Celular sugiere también que dicha proteína juega un papel relevante en la regulación del ciclo celular y en la modulación del estrés oxidativo -aumento de radicales libres- que puede dañar a las células.
Explicaron que los resultados de su labor muestran que la Bcl-2 puede comportarse como molécula prooxidante y que, al igual que una vacuna, pone en alerta a las células para que estén mejor preparadas para cuando se presente un estrés oxidativo importante
Este blog tiene como finalidad compartir conocimientos fundamentales de Química y presentar algunos temas que consideramos oportuno dar a conocer para el enriquecimiento de los visitantes que pasen por aquí...
Sunday, December 30, 2007
Friday, December 14, 2007
TALLER DE DISEÑO DE ESTRATEGIAS DE APRENDIZAJE WWW

Hola, durante los días del 13 al 15 de diciembre llevamos un taller en que aprendimos a crear blogs. Cada participante creó el suyo y podrás visitarlos al dar clic sobre su nombre:
INFORMATICA1SEM
LENGUAJE
Wednesday, November 14, 2007
GUIA DE ESTUDIO TERCER PARCIAL - GRUPOS 102, 105 Y 109
INSTRUCCIONES PREVIAS:
A) La resolución de esta guía de examen es OPCIONAL
B) La guía cuenta para la calificación SOLAMENTE si se encuentra totalmente resuelta
C) La guía incrementa en un 20% la calificación del examen
D) La guía debe entregarse en hojas blancas, con una portada y ANTES de la aplicación del examen.
E) La aplicación del examen será el miércoles 21 de noviembre para los grupos 102 y 109, mientras que para el grupo 105 será el jueves 22
1.- ¿Cuál es el enunciado de la regla del octeto?
2.- ¿ A qué se le llama “capa de valencia”?
3.- ¿Qué es una estructura de Lewis?
4.- ¿Cómo se indica la estructura de Lewis para elementos químicos que pertenecen a grupos representativos (A)?
5.- ¿Qué es un ion? ¿Cómo se forma?
6.- ¿Qué nombre se le da a los iones positivos?
7.- ¿Cómo se llaman a los iones negativos?
8.- ¿Qué es la electronegatividad? ¿En qué unidades se mide?
9.- ¿Por qué se dice que la electronegatividad es una propiedad periódica?
10.- ¿Entre qué tipo de átomos se establece el enlace iónico?
11.- ¿Cuál es el mecanismo de formación del enlace iónico?
12.- ¿Cuáles son las propiedades de los compuestos iónicos?
13.- ¿Cómo se sabe, a partir de la diferencia de electronegatividad, qué tipo de enlace se establece?
14.- ¿Entre qué tipo de átomos se establece el enlace covalente no polar?
15.- ¿Cuáles son las características principales del enlace covalente no polar?
16.- ¿Por qué razón se forman dipolos en el enlace covalente polar?
17.- ¿Cómo se forma el enlace covalente coordinado?
18.- ¿Cómo se dibuja, correctamente una estructura de Lewis? ¿Cuáles son los pasos que deben seguirse? Anota al menos dos ejemplos.
19.- ¿Cómo se establece cuál es la geometría molecular de un compuesto? ¿Qué debe tomarse en cuenta? Anota al menos dos ejemplos.
20.- ¿Cuáles son las propiedades de los compuestos covalentes?
21.- ¿Qué dice la teoría del “mar de electrones”?
22.- ¿Qué expresa la teoría de bandas?
23.- ¿Cuáles son las propiedades de los metales?
24.- ¿Qué es la energía de ionización? ¿Cómo varía dentro de la tabla periódica?
25.- ¿Qué elementos tienen un mayor valor de energía de ionización? ¿Qué significa esto?
26.- ¿Qué es una fuerza intermolecular? ¿Qué efecto tiene sobre las propiedades de las sustancias?
27.- ¿Entre qué tipo de moléculas se establece la atracción dipolo-dipolo?
28.- ¿Cómo se forma un dipolo instantáneo? ¿Qué tan fuerte es?
29.- ¿Qué es el puente de hidrógeno? ¿Qué tipo de compuestos lo presentan?
30.- ¿Cuáles son las propiedades principales del agua?
31.- ¿Solamente el agua presenta puente de hidrógeno?
32.- ¿A qué se le llama “nuevos materiales”? ¿Cómo impactarán en la vida de la sociedad humana?
33.- ¿Qué es una reacción química? ¿Cuáles son los cuatro tipos de reacciones químicas?
34.- ¿Cómo se balancea una ecuación por el método de tanteo? Anota un ejemplo.
35.- ¿Cómo se balancea una ecuación por el método de óxido-reducción? Anota un ejemplo.
A) La resolución de esta guía de examen es OPCIONAL
B) La guía cuenta para la calificación SOLAMENTE si se encuentra totalmente resuelta
C) La guía incrementa en un 20% la calificación del examen
D) La guía debe entregarse en hojas blancas, con una portada y ANTES de la aplicación del examen.
E) La aplicación del examen será el miércoles 21 de noviembre para los grupos 102 y 109, mientras que para el grupo 105 será el jueves 22
1.- ¿Cuál es el enunciado de la regla del octeto?
2.- ¿ A qué se le llama “capa de valencia”?
3.- ¿Qué es una estructura de Lewis?
4.- ¿Cómo se indica la estructura de Lewis para elementos químicos que pertenecen a grupos representativos (A)?
5.- ¿Qué es un ion? ¿Cómo se forma?
6.- ¿Qué nombre se le da a los iones positivos?
7.- ¿Cómo se llaman a los iones negativos?
8.- ¿Qué es la electronegatividad? ¿En qué unidades se mide?
9.- ¿Por qué se dice que la electronegatividad es una propiedad periódica?
10.- ¿Entre qué tipo de átomos se establece el enlace iónico?
11.- ¿Cuál es el mecanismo de formación del enlace iónico?
12.- ¿Cuáles son las propiedades de los compuestos iónicos?
13.- ¿Cómo se sabe, a partir de la diferencia de electronegatividad, qué tipo de enlace se establece?
14.- ¿Entre qué tipo de átomos se establece el enlace covalente no polar?
15.- ¿Cuáles son las características principales del enlace covalente no polar?
16.- ¿Por qué razón se forman dipolos en el enlace covalente polar?
17.- ¿Cómo se forma el enlace covalente coordinado?
18.- ¿Cómo se dibuja, correctamente una estructura de Lewis? ¿Cuáles son los pasos que deben seguirse? Anota al menos dos ejemplos.
19.- ¿Cómo se establece cuál es la geometría molecular de un compuesto? ¿Qué debe tomarse en cuenta? Anota al menos dos ejemplos.
20.- ¿Cuáles son las propiedades de los compuestos covalentes?
21.- ¿Qué dice la teoría del “mar de electrones”?
22.- ¿Qué expresa la teoría de bandas?
23.- ¿Cuáles son las propiedades de los metales?
24.- ¿Qué es la energía de ionización? ¿Cómo varía dentro de la tabla periódica?
25.- ¿Qué elementos tienen un mayor valor de energía de ionización? ¿Qué significa esto?
26.- ¿Qué es una fuerza intermolecular? ¿Qué efecto tiene sobre las propiedades de las sustancias?
27.- ¿Entre qué tipo de moléculas se establece la atracción dipolo-dipolo?
28.- ¿Cómo se forma un dipolo instantáneo? ¿Qué tan fuerte es?
29.- ¿Qué es el puente de hidrógeno? ¿Qué tipo de compuestos lo presentan?
30.- ¿Cuáles son las propiedades principales del agua?
31.- ¿Solamente el agua presenta puente de hidrógeno?
32.- ¿A qué se le llama “nuevos materiales”? ¿Cómo impactarán en la vida de la sociedad humana?
33.- ¿Qué es una reacción química? ¿Cuáles son los cuatro tipos de reacciones químicas?
34.- ¿Cómo se balancea una ecuación por el método de tanteo? Anota un ejemplo.
35.- ¿Cómo se balancea una ecuación por el método de óxido-reducción? Anota un ejemplo.
Saturday, October 13, 2007
DIAPOSITIVAS PARA APRENDER SOBRE LOS ENLACES QUÍMICOS
Una parte importante del aprendizaje de la Química incluye el estudio de los enlaces químicos, porque ayudan a que entendamos la estructura y las propiedades de los compuestos químicos que se derivan de la forma en que están enlazados los átomos.
Así, por ejemplo, la sal común (cloruro de sodio)tiene entre sus propiedades mostrar una estructura cristalina cúbica, separarse en iones sodio y cloruro, cuando se disuelve en agua es capaz de transmitir una corriente eléctrica, además de tener un alto punto de fusión y de ebullición porque se origina de un enlace de tipo iónico o electrovalente. Por su parte el agua es capaz de disolver a un gran número de sustancias, formar puentes de hidrógeno con otras moléculas de agua, asimilar una gran cantidad de energía calorífica, etc. porque se origina de un enlace covalente polar.
En los enlaces que se colocan a continuación podrás revisar algunas presentaciones en power point que te servirán para aprender -o si ya aprendiste- para repasar y profundizar en este tema.
Para tener acceso a las presentaciones selecciona la dirección, cópiala y pégala en la ventana de búsqueda de tu navegador.
1.- www.acienciasgalilei.com/alum/qui/lewis.ppt
2.- www.unap.cl/public/ENLACE%20QUIMICO.ppt
3.- depa.fquim.unam.mx/Inorganica/powerpoint/covalente.ppt
Así, por ejemplo, la sal común (cloruro de sodio)tiene entre sus propiedades mostrar una estructura cristalina cúbica, separarse en iones sodio y cloruro, cuando se disuelve en agua es capaz de transmitir una corriente eléctrica, además de tener un alto punto de fusión y de ebullición porque se origina de un enlace de tipo iónico o electrovalente. Por su parte el agua es capaz de disolver a un gran número de sustancias, formar puentes de hidrógeno con otras moléculas de agua, asimilar una gran cantidad de energía calorífica, etc. porque se origina de un enlace covalente polar.
En los enlaces que se colocan a continuación podrás revisar algunas presentaciones en power point que te servirán para aprender -o si ya aprendiste- para repasar y profundizar en este tema.
Para tener acceso a las presentaciones selecciona la dirección, cópiala y pégala en la ventana de búsqueda de tu navegador.
1.- www.acienciasgalilei.com/alum/qui/lewis.ppt
2.- www.unap.cl/public/ENLACE%20QUIMICO.ppt
3.- depa.fquim.unam.mx/Inorganica/powerpoint/covalente.ppt
Thursday, October 11, 2007
Enlaces entre átomos
Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las distintas sustancias se denominan enlaces químicos.
¿Por qué se unen los átomos?
Los átomos se unen porque, al estar unidos, adquieren una situación más estable que cuando estaban separados.
Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles.
Los gases nobles tienen muy poca tendencia a formar compuestos y suelen encontrarse en la naturaleza como átomos aislados. Sus átomos, a excepción del helio, tienen 8 electrones en su último nivel. Esta configuración electrónica es extremadamente estable y a ella deben su poca reactividad.
Podemos explicar la unión de los átomos para formar enlaces porque con ella consiguen que su último nivel tenga 8 electrones, la misma configuración electrónica que los átomos de los gases nobles. Este principio recibe el nombre de regla del octeto y aunque no es general para todos los átomos, es útil en muchos casos.
Distintos tipos de enlaces
Las propiedades de las sustancias dependen en gran medida de la naturaleza de los enlaces que unen sus átomos.
Existen tres tipos principales de enlaces químicos: enlace iónico, enlace covalente y enlace metálico. Estos enlaces, al condicionar las propiedades de las sustancias que los presentan, permiten clasificarlas en: iónicas, covalentes y metálicas o metales.
Para seguir leyendo y ver interesantes animaciones sobre los enlaces químicos, da click aquí >>>>>
¿Por qué se unen los átomos?
Los átomos se unen porque, al estar unidos, adquieren una situación más estable que cuando estaban separados.
Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles.
Los gases nobles tienen muy poca tendencia a formar compuestos y suelen encontrarse en la naturaleza como átomos aislados. Sus átomos, a excepción del helio, tienen 8 electrones en su último nivel. Esta configuración electrónica es extremadamente estable y a ella deben su poca reactividad.
Podemos explicar la unión de los átomos para formar enlaces porque con ella consiguen que su último nivel tenga 8 electrones, la misma configuración electrónica que los átomos de los gases nobles. Este principio recibe el nombre de regla del octeto y aunque no es general para todos los átomos, es útil en muchos casos.
Distintos tipos de enlaces
Las propiedades de las sustancias dependen en gran medida de la naturaleza de los enlaces que unen sus átomos.
Existen tres tipos principales de enlaces químicos: enlace iónico, enlace covalente y enlace metálico. Estos enlaces, al condicionar las propiedades de las sustancias que los presentan, permiten clasificarlas en: iónicas, covalentes y metálicas o metales.
Para seguir leyendo y ver interesantes animaciones sobre los enlaces químicos, da click aquí >>>>>
Múltiples aplicaciones de la química de superficies

Ertl, quien este miércoles cumple 71 años, dijo no tener palabras para describir la emoción.
Tras conocerse el nombre del ganador del galardón, el presidente del Comité Nobel de Química, Gunna von Heijne, dijo: "Tendemos a pensar en la química como algo que tiene que ver con los líquidos y los gases, pero la química de las superficies es muy interesante científicamente hablando y es muy práctica. La química tiene lugar en superficies sólidas".
"En casos como la oxidación del hierro, los catalizadores de los coches o las pilas de combustible estamos hablando de química de superficies", añadió von Heijne.
Según explicó en un comunicado el comité que otorgó el premio, "las reacciones químicas sobre las superficies catalíticas juegan un papel vital en numerosas operaciones industriales, como la producción de fertilizantes artificiales, e incluso puede explicar la destrucción de la capa de ozono".
La ciencia moderna de la química de superficies se inició en los años 60, a partir de procesos utilizados en la industria de los semiconductores.
El profesor Ertl creó una metodología para la química de superficies demostrando los diferentes procedimientos experimentales que pueden utilizarse para ofrecer una imagen completa de una reacción en una superficie.
Este campo científico requiere equipos avanzados para observar como capas individuales de átomos y moléculas actúan en las superficies extremadamente puras de un metal.
Nota tomada de BBC mundo
Wednesday, October 10, 2007
Otorgan al alemán Gerhard Ertl el Nobel de Química 2007

EFE
El Universal
Estocolmo, Suecia
Miércoles 10 de octubre de 2007
06:17 La Real Academia de Ciencias de Suecia decidió este año otorgar el Premio Nobel de Química al investigador alemán, Gerhard Ertl, cuyos estudios de los procesos químicos sobre superficies sólidas son determinantes en toda una serie de campos industriales, como, por ejemplo, la automoción.
Ertl, quien celebra justamente este miércoles su 71 cumpleaños, fue uno de los primeros químicos que aprovechó las tecnologías que se utilizan sobre todo en la industria de semiconductores al desarrollar un método para la química de superficies que sentó las bases para posteriores avances en este campo.
El químico descubrió cómo utilizar distintos métodos experimentales para obtener un cuadro completo de una reacción química sobre las superficies.
Según destacó la Academia, estos métodos son de especial relevancia en la industria química y ayudan a comprender procesos tan distintos como la oxidación del hierro, el funcionamiento de las células de combustión o el del catalizador en el automóvil.
Mediante esta especialidad química se puede hasta explicar la destrucción de la capa de ozono, pues algunos de los procesos determinantes de esta reacción se producen en la superficie de los pequeños cristales de hielo en la estratosfera.
También la industria de los semiconductores es un campo que depende de la química de las superficies.
Ertl nació en Bad Canstatt, se doctoró en la Universidad Técnica de Múnich en 1965 y ha sido profesor de química y de física en Universidades de Alemania y Estados Unidos.
Desde 2004 es profesor emérito del Instituto Fritz-Haber de la Sociedad Max-Planck de Berlín.
Ertl es el segundo alemán en ser galardonado este año con un Nobel, tras Peter Grünberg, quien ayer fue premiado con el de Física junto a su colega francés Albert Fert.
El año pasado el Nobel de Química recayó en el estadounidense Roger D. Kronberg por sus investigaciones en el campo de la genética.
El Nobel de Química está dotado con 10 millones de coronas suecas (1.1 millones de euros o 1.5 millones de dólares) y se entregará junto al resto de los galardones el 10 de diciembre, aniversario de la muerte de su fundador, Alfred Nobel.
Tuesday, September 04, 2007
El punto que une a la ciencia con el arte

Notimex
El Universal
México
Martes 04 de septiembre de 2007
Un total de 38 fotografías en las que el autor, a través de objetos, paisajes y fenómenos diversos, captura el punto exacto que une al arte con la ciencia, conforman la exposición El punto de la ciencia y el arte, inaugurada en el Museo de las Ciencias, Universum.
Exhibida en el marco de las actividades de Fotoseptiembre 2007, la muestra está inspirada en la publicación "Punto y línea sobre el plano" , del pintor ruso, precursor de la abstracción en pintura Wasily Kandinsky, explicó a Notimex el artista e investigador de la UNAM, Arturo Orta Fuentes. "Me llamó la atención el hecho de que vemos al punto todo el tiempo y no le tomamos atención. Me di cuenta que con respecto al punto existen muchas cosas, por ejemplo que es geométrico y mudo" , señaló. En formato mediano y en blanco y negro se presenta una serie de imágenes relacionadas con el punto, tales como el punto de ebullición de un experimento químico, el punto de soporte en herramientas diversas, el punto de vista geométrico en un paisaje con perspectiva o bien, el punto y la coma en la literatura.
De acuerdo con el artista, el objeto de la muestra es divulgar la ciencia, es decir, que los visitantes tengan presente que el punto está en todos lados.
"El punto es un pequeño mundo donde existe la geometría, la física, la química, la danza, la música, la arquitectura, la pintura, la escultura, las matemáticas; donde se cruzan las líneas pero también donde se unen una curva y una recta" , añadió.
Reserva ecológica
También fue inaugurada la exposición La Reserva Ecológica del Pedregal de San Angel, una colección de 90 fotografías a color agrupadas por separado para formar 15 instalaciones diferentes, en las que su autor, Ernesto Navarrete, exhibe lo que coexiste en ese espacio ubicado en terrenos de Ciudad Universitaria.
De acuerdo con el fotógrafo, el objetivo es demostrar que no es un lote baldío, sino un ecosistema con una importancia trascendental para mantener el equilibrio del medio ambiente en la Ciudad de México.
Según el artista, el Pedregal de San Angel es un lugar agreste e inaccesible, propio de exploraciones y curiosos. Este ecosistema, resultado de derrame de lava durante le erupción del volcán Xitle, hace más de 200 años, es único en el mundo.
La Reserva Ecológica del Pedregal de San Angel (REPSA) , enclavada en Ciudad Universitaria, coexiste con uno de los sistemas urbanos más complejos y contaminados del planeta.
Este hábitat alberga parte de la rica biodiversidad que antes se encontraba ampliamente distribuida en la cuenca de México; asimismo, tiene un gran valor ecológico y geomorfológico ", explicó Antonio Lot, responsable de la reserva. Por separado, Julia Tagueña, directora del Universum, indicó que ambas muestras son una mezcla de ciencia y arte, ya que " tienen que ver con temas científicos e incluyen cierta interactividad emocional.
El punto de la ciencia y el arte y La Reserva Ecológica del Pedregal de San Angel
Hasta la primera semana de noviembre
Universum, Museo de las Ciencias de la UNAM
Zona Cultural de Ciudad Universitaria Apartado Postal 70-487, Coyoacán 04510
Lunes a viernes de 9 a 18 hrs. (La taquilla cierra a las 17 hrs.)
Sábados, domingos y días festivos de 10 a 18 hrs. (La taquilla cierra a las 17 hrs.)
Entrada general: $40.00
Niños, estudiantes, maestros y trabajadores UNAM con credencial vigente: $35.00
Miembros del INAPAM: entrada gratuita (solicitar su pase de entrada en la taquilla del museo presentando su credencial -indispensable-)
Saturday, September 01, 2007
ACTIVIDAD EXPERIMENTAL OPCIONAL
Hola, alumnos de los grupos 102, 105 y 109:
La práctica de separación de mezclas la pueden encontrar en las entradas del mes de Marzo de 2006 y, aunque la recomendación es hacerlo en equipos de cuatro integrantes como máximo, la pueden hacer individualmente.
Reciban saludos y nos vemos en clase.
Atentamente,
Prof. Víctor Mora
La práctica de separación de mezclas la pueden encontrar en las entradas del mes de Marzo de 2006 y, aunque la recomendación es hacerlo en equipos de cuatro integrantes como máximo, la pueden hacer individualmente.
Reciban saludos y nos vemos en clase.
Atentamente,
Prof. Víctor Mora
Thursday, June 07, 2007
GUÍA EXAMEN SEMESTRAL QUIMICA 2
GUIA EXAMEN SEMESTRAL
INSTRUCCIONES:
1.- La resolución de la guía es opcional, pero si se entrega completa y correctamente resuelta se tomará en cuenta para mejorar la calificación del examen semestral.
2.-La guía se ha seccionado en dos partes, cada una de ellas se entregará en la Academia de Ciencias Naturales de acuerdo a la calendarización que se detalla enseguida:
• Primera parte: lunes 11 de junio de 2007 de las 7:00 a 7:50 horas (no hay prórroga)
• Segunda parte: miércoles 13 de junio de 2007 7:00 a 7:50 horas (recuerda, no hay prórroga ni de día ni de hora)
3.- Recuerda que el examen semestral se presentará el jueves 14 de junio a las 8:00 hrs. en punto. Podrás llevar exclusivamente tabla periódica, tabla de aniones y cationes y calculadora para contestar tu examen.
PRIMERA PARTE
Temas que deberás estudiar para resolver la primera parte de la guía:
1.- Nomenclatura de compuestos químicos más comunes:
Óxidos metálicos
Óxidos no metálicos
Hidróxidos
Sales binarias
Hidrácidos
Oxiácidos
Oxisales
2.- Escritura de ecuaciones químicas
3.- Tipos de reacción química:
Síntesis
Descomposición
Sustitución simple
Doble sustitución
4.- Balanceo de ecuaciones químicas:
Método de tanteo
Método de óxido-reducción
Preguntas y problemas para responder y entregar en hojas blancas y con su carátula correspondiente:
5.- Escribe los nombres de los siguientes compuestos:
Na2O
N2O5
HBr
CaCl2
MgSO4
H3PO4
6.- Escribe la fórmula que corresponda:
Óxido de aluminio
Pentóxido de dicloro
Ácido sulfhídrico
Ácido carbónico
Nitrato de hierro (III)
Bromuro de mercurio (II)
7.- Escribe las ecuaciones químicas siguientes:
Hidróxido de calcio + ácido nítrico → nitrato de calcio + agua
Cianuro de sodio + sulfato de cobre (II) → cianuro de cobre (I) + sulfato de sodio.
8.- Busca y escribe un ejemplo de reacción de (a) sustitución simple; (b) doble sustitución; (c) descomposición y (d) síntesis.
9.- Balancea las siguientes ecuaciones químicas:
C2H5OH + O2 → CO2 + H2O
Al2S3 + H2O → H2S + Al(OH)3
GUIA SEMESTRAL - SEGUNDA PARTE
A) Temas que deberás estudiar:
Estequiometría
Mol
Masa Molar
Composición porcentual
Fórmula mínima
Fórmula molecular
Relaciones masa-masa
Relaciones mol-mol
Volumen molar
Relaciones volumen-volumen
Características de las disoluciones
Características de los coloides
Caracteristicas de las suspensiones
Métodos de separación de mezclas
Ósmosis
Floculación
Concentración de las disoluciones: Porcentaje en masa, molaridad, normalidad
Preguntas y problemas para responder y entregar:
1.- ¿A qué se le llama mol? ¿a cuantas partículas equivale?
2.- ¿Cuántos moles y cuántos átomos hay en 69 g de Na puro?
¿Cuántos moles y cuántas moléculas hay en 107 g de cloruro de amonio (NH4Cl)?
3.- Calcula la composición porcentual del sulfito de potasio, K2SO3.
4.-El cromo tiene tres diferentes óxidos, cada uno con 74.0 %, 68.4 % y 76.5 % del metal. ¿Cuáles son sus fórmulas mínimas?
5.- El polvo para hornear es una mezcla de cremor tártaro (tartrato ácido de potasio) y bicarbonato de sodio. Al calentarlo, se produce dióxido de carbono, que es el responsable de que el pastel “suba” y se esponje. La reacción es la siguiente:
KHC4H4O6 + NaHCO3 → KNaH4C4O6 + H2O + CO2
Si tienes 0.1 mol de bicarbonato de sodio (NaHCO3), ¿cuántos gramos de cremor tártaro (KHC4H4O6) necesitas?, ¿cuántos litros de dióxido de carbono se obtendrán, si la reacción se lleva a cabo a TPN?
6.- Explica la diferencia entre una fase dispersa y una fase dispersora.
7.- ¿De qué tamaño es la partícula en una disolución? ¿de qué tamaño en un coloide y de qué proporciones en una suspensión?
8.- ¿En qué consiste el fenómeno de la ósmosis?
9.-Se preparó una solución con 40.0 g de KOH y 2000 g de H2O. Calcula la concentración en porcentaje en peso.
10.- Se disuelven 4.9 g de ácido fosfórico (H3PO4) en agua suficiente para preparar 750 mL de solución. Calcula la molaridad y la normalidad de la solución.
B) Temas que deberás estudiar:
Configuración electrónica del átomo de carbono
Hibridación sp, sp2 y sp3.
Geometría molecular según el tipo de hibridación.
Alcanos: estructura y nomenclatura.
Alquenos: estructura y nomenclatura.
Alquinos: estructura y nomenclatura.
Hidrocarburos aromáticos: estructura y nomenclatura.
Grupos funcionales: alcohol, aldehído, cetona, ácido carboxílico, éter, amina, amida, éster, halogenuro de alquilo.
Preguntas y problemas para responder y entregar:
1.- Explica la formación de los tres tipos de hibridación (sp, sp2 y sp3) para el átomo de carbono y qué geometría molecular le corresponde a cada una de ellas.
2.- Dibuja la estructura de los siguientes compuestos:
3,3-dimetilpentano
1,3-pentadieno
acetileno
etilbenceno
2,4-diclorotolueno
Nota importante: La guía continúa...
INSTRUCCIONES:
1.- La resolución de la guía es opcional, pero si se entrega completa y correctamente resuelta se tomará en cuenta para mejorar la calificación del examen semestral.
2.-La guía se ha seccionado en dos partes, cada una de ellas se entregará en la Academia de Ciencias Naturales de acuerdo a la calendarización que se detalla enseguida:
• Primera parte: lunes 11 de junio de 2007 de las 7:00 a 7:50 horas (no hay prórroga)
• Segunda parte: miércoles 13 de junio de 2007 7:00 a 7:50 horas (recuerda, no hay prórroga ni de día ni de hora)
3.- Recuerda que el examen semestral se presentará el jueves 14 de junio a las 8:00 hrs. en punto. Podrás llevar exclusivamente tabla periódica, tabla de aniones y cationes y calculadora para contestar tu examen.
PRIMERA PARTE
Temas que deberás estudiar para resolver la primera parte de la guía:
1.- Nomenclatura de compuestos químicos más comunes:
Óxidos metálicos
Óxidos no metálicos
Hidróxidos
Sales binarias
Hidrácidos
Oxiácidos
Oxisales
2.- Escritura de ecuaciones químicas
3.- Tipos de reacción química:
Síntesis
Descomposición
Sustitución simple
Doble sustitución
4.- Balanceo de ecuaciones químicas:
Método de tanteo
Método de óxido-reducción
Preguntas y problemas para responder y entregar en hojas blancas y con su carátula correspondiente:
5.- Escribe los nombres de los siguientes compuestos:
Na2O
N2O5
HBr
CaCl2
MgSO4
H3PO4
6.- Escribe la fórmula que corresponda:
Óxido de aluminio
Pentóxido de dicloro
Ácido sulfhídrico
Ácido carbónico
Nitrato de hierro (III)
Bromuro de mercurio (II)
7.- Escribe las ecuaciones químicas siguientes:
Hidróxido de calcio + ácido nítrico → nitrato de calcio + agua
Cianuro de sodio + sulfato de cobre (II) → cianuro de cobre (I) + sulfato de sodio.
8.- Busca y escribe un ejemplo de reacción de (a) sustitución simple; (b) doble sustitución; (c) descomposición y (d) síntesis.
9.- Balancea las siguientes ecuaciones químicas:
C2H5OH + O2 → CO2 + H2O
Al2S3 + H2O → H2S + Al(OH)3
GUIA SEMESTRAL - SEGUNDA PARTE
A) Temas que deberás estudiar:
Estequiometría
Mol
Masa Molar
Composición porcentual
Fórmula mínima
Fórmula molecular
Relaciones masa-masa
Relaciones mol-mol
Volumen molar
Relaciones volumen-volumen
Características de las disoluciones
Características de los coloides
Caracteristicas de las suspensiones
Métodos de separación de mezclas
Ósmosis
Floculación
Concentración de las disoluciones: Porcentaje en masa, molaridad, normalidad
Preguntas y problemas para responder y entregar:
1.- ¿A qué se le llama mol? ¿a cuantas partículas equivale?
2.- ¿Cuántos moles y cuántos átomos hay en 69 g de Na puro?
¿Cuántos moles y cuántas moléculas hay en 107 g de cloruro de amonio (NH4Cl)?
3.- Calcula la composición porcentual del sulfito de potasio, K2SO3.
4.-El cromo tiene tres diferentes óxidos, cada uno con 74.0 %, 68.4 % y 76.5 % del metal. ¿Cuáles son sus fórmulas mínimas?
5.- El polvo para hornear es una mezcla de cremor tártaro (tartrato ácido de potasio) y bicarbonato de sodio. Al calentarlo, se produce dióxido de carbono, que es el responsable de que el pastel “suba” y se esponje. La reacción es la siguiente:
KHC4H4O6 + NaHCO3 → KNaH4C4O6 + H2O + CO2
Si tienes 0.1 mol de bicarbonato de sodio (NaHCO3), ¿cuántos gramos de cremor tártaro (KHC4H4O6) necesitas?, ¿cuántos litros de dióxido de carbono se obtendrán, si la reacción se lleva a cabo a TPN?
6.- Explica la diferencia entre una fase dispersa y una fase dispersora.
7.- ¿De qué tamaño es la partícula en una disolución? ¿de qué tamaño en un coloide y de qué proporciones en una suspensión?
8.- ¿En qué consiste el fenómeno de la ósmosis?
9.-Se preparó una solución con 40.0 g de KOH y 2000 g de H2O. Calcula la concentración en porcentaje en peso.
10.- Se disuelven 4.9 g de ácido fosfórico (H3PO4) en agua suficiente para preparar 750 mL de solución. Calcula la molaridad y la normalidad de la solución.
B) Temas que deberás estudiar:
Configuración electrónica del átomo de carbono
Hibridación sp, sp2 y sp3.
Geometría molecular según el tipo de hibridación.
Alcanos: estructura y nomenclatura.
Alquenos: estructura y nomenclatura.
Alquinos: estructura y nomenclatura.
Hidrocarburos aromáticos: estructura y nomenclatura.
Grupos funcionales: alcohol, aldehído, cetona, ácido carboxílico, éter, amina, amida, éster, halogenuro de alquilo.
Preguntas y problemas para responder y entregar:
1.- Explica la formación de los tres tipos de hibridación (sp, sp2 y sp3) para el átomo de carbono y qué geometría molecular le corresponde a cada una de ellas.
2.- Dibuja la estructura de los siguientes compuestos:
3,3-dimetilpentano
1,3-pentadieno
acetileno
etilbenceno
2,4-diclorotolueno
Nota importante: La guía continúa...
Continuación de la segunda parte de la guía....

3.- Escribe el nombre correcto para los compuestos que se presentan en la figura anterior.
4. Escribe la fórmula que corresponde al grupo funcional:
a) Alcohol ___________
b) Acido carboxílico _____________
c) Eter___________
d) Ester___________
e) Aldehído___________
f) Cetona___________
g) Halogenuro de alquilo___________
h) Amina___________
i) Amida___________
Friday, June 01, 2007
Elaboran genoma de descubridor de estructura de ADN

AP
El Universal
Texas, EU
Jueves 31 de mayo de 2007
El científico que fue uno de los descubridores de la estructura molecular del ADN -y recibió el premio Nobel por ello- se ha convertido en la primera persona en recibir el mapa de su propio genoma.
El mapa, un análisis de su ADN que revela cuáles enfermedades está predispuesto a contraer, es el primer paso para hacer de las secuencias individuales del genoma humano un proceso rápido, accesible y parte de la atención médica de rutina, dijeron los investigadores.
"Sabía que me arriesgaba a un ataque de angustia cuando lo vi", dijo James Watson, de 79 años, al recibir el mapa durante una ceremonia en el Baylor College of Medicine. "Pero si no duermo de noche, es porque pienso mucho más en Irak que en mi genoma".
Watson fue escogido para el proyecto debido a sus aportes a la genética, y el mapa fue realizado con una muestra de sangre suya.
El estudio reveló que tiene algunas variaciones que pueden inducir el cáncer, lo cual parece reflejar su verdadero estado de salud. Watson dijo que ha padecido cáncer de piel y su hermana tuvo cáncer de mama.
El proyecto, que duró dos meses y tuvo un costo de 1 millón de dólares, fue una colaboración entre 454 Life Sciences Corp., una empresa privada especializada en secuenciar el ADN, y el Centro de Secuenciamiento de ADN de Baylor. Por el momento no existen planes de elaborar nuevos mapas, aunque los investigadores quieren hacerlo en el futuro.
El Proyecto Genoma Humano, considerado un hito en la historia de la ciencia, fue un esfuerzo internacional, financiado con fondos públicos, para identificar los 20 mil a 25 mil genes del ADN humano. Tomó 13 años de trabajo y tuvo un costo de 3 mil millones de dólares.
Watson, uno de los ganadores del Nobel por el descubrimiento de la estructura del ADN en 1953, y que lanzó el Proyecto Genoma Humano en 1990, dijo que es necesario hacer mapas de miles de genomas individuales antes que los investigadores puedan interpretar la información que reciben.
Monday, May 28, 2007
Fumar al aire libre: riesgo para todos

El Universal
Lunes 28 de mayo de 2007
Cientos de miles de personas que no fuman, pero inhalan el humo de los fumadores, mueren cada año en todo el mundo. Hasta la fecha se pensaba que el daño provenía de la inhalación de gases tóxicos en lugares cerrados; sin embargo, una investigación reciente efectuada en la Universidad de Stanford, determinó que los contaminantes producidos por la combustión del tabaco resultan nocivos para la salud, aun en lugares al descubierto, ello sin contar con que contribuyen de manera importante a la contaminación del medio ambiente.
Los resultados del estudio, que se centró en analizar la calidad del aire en cafés situados sobre las banquetas, bancas de parques públicos y otras locaciones al aire libre, concluyen que una persona ubicada en las cercanías de un fumador está expuesta a niveles importantes de contaminación.
"Algunas personas opinan que la exposición al humo del tabaco al aire libre es insignificante. Sin embargo, nuestros hallazgos muestran que un fumador pasivo que se encuentra cerca de un fumador inhala contaminantes varias veces más concentrados que los hallados en los niveles registrados en el aire", dijo Neil Klepeis, especialista en ingeniería ambiental.
En ese sentido, el experto recordó que incluso la exposición por breves periodos al humo del tabaco puede acarrear efectos adversos para la salud, particularmente para los niños.
"Nos sorprendió descubrir que la exposición al humo en sitios al aire libre es similar, en cuanto a los niveles de contaminantes, a los registrados en promedio en lugares cerrados como casas y bares", dijo Wayne Ott, coautor del estudio.
"Por ejemplo, si usted se encuentra sentado en un café al aire libre a menos de un metro de una persona que fuma dos cigarrillos en el transcurso de una hora, estará expuesto al humo del tabaco de la misma forma que si estuviera dentro de un bar por una hora conviviendo con fumadores. Asimismo, los niños situados en la proximidad de un fumador en un lugar al aire libre también están expuestos al humo de manera importante", agregó.
A diferencia del humo de tabaco en lugares cerrados, que puede persistir por horas, el humo emitido en lugares abiertos desaparece rápidamente. Klepeis afirma que "si usted se ubica a un promedio de dos metros de distancia de un fumador al aire libre, su exposición a los niveles de contaminación se reducirán de manera considerable".
Muchos países han externado su preocupación por la contaminación que produce el humo del tabaco prohibiendo fumar en edificios públicos y localidades al aire libre. Para Ott, "el problema es que hasta ahora no existían soportes científicos para justificar esas restricciones. Nuestro estudio es el primero en torno de los efectos del humo del tabaco en exteriores", dijo.
Los investigadores utilizaron monitores electrónicos portátiles para hacer lecturas precisas de las partículas tóxicas emitidas por el humo de cigarrillos. "Queríamos cuantificar el nivel potencial de exposición al humo del tabaco en sitios al aire libre en condiciones cotidianas. Para ello utilizamos cinco instrumentos diferentes en sitios como parques, cafés al aire libre y banquetas, donde hay presencia de fumadores", explicó el especialista.
Cada instumento fue calibrado para medir un contaminante conocido como PM2.5, que consiste en miles de partículas microscópicas cuyo tamaño no alcanza los 2.5 micrometros, es decir unas 30 veces más pequeñas que el grueso de un cabello humano.
Ott explicó que "el PM2.5 es un contaminante producido por la combustión de cigarrillos, madera y diesel, entre otras fuentes. Contiene benzopireno, que es carcinógeno, y muchas otras sustancias químicas tóxicas que pueden penetrar profundamente en los pulmones".
Según la Agencia de Protección Ambiental estadounidense, la exposición a PM2.5 puede producir ataques de asma, bronquitis crónica, ritmo cardiaco irregular e incluso muerte prematura.
Los estándares promedio de PM2.5 en el ambiente son de 35 microgramos por centímetro cúbico de aire en un lapso de 24 horas. Los niveles que exceden esta cifra son considerados como peligrosos para la salud de las personas. "Dado que el humo del tabaco contiene muchos componentes tóxicos, incluyendo carcinógenos, inhalarlo puede ser más dañino que respirar la típica contaminación del aire", comentó Klepeis.
Para medir los niveles de PM2.5 en el humo de tabaco, los investigadores colocaron los instrumentos cerca de fumadores en distintos espacios al aire libre, a diferentes distancias. Los resultados fueron muy claros: mientras más cerca se encuentra una persona de alguien que fuma al aire libre, mayor es la exposición a los contaminantes tóxicos emitidos por el humo.
Según Klepeis, "un cigarrillo dura 10 minutos, en promedio. Si usted está a unos 70 centímetros de un fumador y en contra del viento, estará expuesto a concentraciones contaminantes que exceden los 500 microgramos de PM2.5 durante ese tiempo.
"Si usted se expone en múltiples ocasiones al humo de cigarrillos por varias horas al aire libre, es muy probable que esté inhalando 35 microgramos o más de PM2.5, lo cual excede los estándares de seguridad."
Si se toma en cuenta que el aire considerado como limpio contiene menos de 20 microgramos de PM2.5, entonces una persona que se encuentra en las cercanías de un fumador al aire libre podría inhalar hasta 50 veces más material tóxico del que recibiría al respirar sólo el aire que se encuentra alrededor.
Así que la próxima vez que desee tomar un café al aire libre, pasear por un parque o simplemente tenga necesidad de caminar por la calle, procure mantenerse alejado de los fumadores. (Universidad de Stanford)
Tuesday, April 17, 2007
EXPOSICIONES DE MÉTODOS DE SEPARACIÓN DE MEZCLAS
A todos aquellos que forman parte de los equipos que expondrán alguno de los métodos de separación de mezclas, les notifico que:
1. El tiempo de exposición será -como máximo- de 5 minutos y tendrán, además 3 minutos para que los demás compañeros del grupo hagan preguntas sobre lo que expusieron.
2. Para asignar la calificación de la exposición se tomarán en cuenta tres aspectos: material de apoyo, contenido de la exposición y respuesta a las preguntas hechas por los compañeros.
Para que tengan una idea más clara de lo que se calificará en la exposición les anoto los detalles siguientes:
a) Material de apoyo: Los estudiantes usan varios apoyos (láminas, dibujos, experimentos) que demuestran considerable trabajo/creatividad y hacen la presentación mejor.
b) Contenido de la exposición: los expositores demuestran un completo entendimiento del tema.
c) Respuesta a las preguntas: Los integrantes del equipo pueden con precisión contestar casi todas las preguntas planteadas sobre el tema por sus compañeros de clase.
3. Para el resto del grupo que estará observando la exposición y haciendo las preguntas a los expositores, calificaré los siguientes aspectos:
a) Atención y respeto a la exposicion: Escuchar atentamente. No hacer movimientos o ruidos que sean molestos.
b) Evaluación del equipo expositor: Llenar la evaluación de sus compañeros completamente y siempre dar la puntuación basada en la presentación y no en otros factores.
1. El tiempo de exposición será -como máximo- de 5 minutos y tendrán, además 3 minutos para que los demás compañeros del grupo hagan preguntas sobre lo que expusieron.
2. Para asignar la calificación de la exposición se tomarán en cuenta tres aspectos: material de apoyo, contenido de la exposición y respuesta a las preguntas hechas por los compañeros.
Para que tengan una idea más clara de lo que se calificará en la exposición les anoto los detalles siguientes:
a) Material de apoyo: Los estudiantes usan varios apoyos (láminas, dibujos, experimentos) que demuestran considerable trabajo/creatividad y hacen la presentación mejor.
b) Contenido de la exposición: los expositores demuestran un completo entendimiento del tema.
c) Respuesta a las preguntas: Los integrantes del equipo pueden con precisión contestar casi todas las preguntas planteadas sobre el tema por sus compañeros de clase.
3. Para el resto del grupo que estará observando la exposición y haciendo las preguntas a los expositores, calificaré los siguientes aspectos:
a) Atención y respeto a la exposicion: Escuchar atentamente. No hacer movimientos o ruidos que sean molestos.
b) Evaluación del equipo expositor: Llenar la evaluación de sus compañeros completamente y siempre dar la puntuación basada en la presentación y no en otros factores.
Monday, April 16, 2007
Experimento sobre disoluciones, coloides y suspensiones
Hola:
La liga para encontrar el experimento sobre disoluciones, coloides y suspensiones se ubica en el mes de mayo de 2006...
La liga para encontrar el experimento sobre disoluciones, coloides y suspensiones se ubica en el mes de mayo de 2006...
Monday, March 05, 2007
JUEGA SUDOKU!!!!
Hola:
El sudoku, juego originario del Japón, es un rompecabezas matemático en el que cada número (del 1 al 9) aparece única y exclusivamente una vez en cada fila y en cada columna. Asimismo, en cada uno de los recuadros pequeños, solamente debe aparecer el número del 1 al 9 una sola vez.
Si quieres jugar, te colocaremos aquí diariamente uno nuevo para que lo copies y resuelvas... ¡adelante!
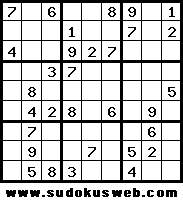
El sudoku, juego originario del Japón, es un rompecabezas matemático en el que cada número (del 1 al 9) aparece única y exclusivamente una vez en cada fila y en cada columna. Asimismo, en cada uno de los recuadros pequeños, solamente debe aparecer el número del 1 al 9 una sola vez.
Si quieres jugar, te colocaremos aquí diariamente uno nuevo para que lo copies y resuelvas... ¡adelante!
Friday, February 23, 2007
GUÍA PARA EXAMEN DEL LUNES 26 DE FEBRERO DE 2007
Notas importantes:
*La resolución de la guía es OPCIONAL
*Si decides resolverla, deberá estar COMPLETAMENTE contestada y deberás entregarla antes del examen. (Se tomará en cuenta la limpieza y presentación de la guia)
*El valor de la guía será de un 20% de la calificación del examen. En otras palabras, el valor de la guía resuelta dependerá de la calificación que obtengas en el examen.
I. Escribe el nombre de las siguientes fórmulas:
RaF2
Mn(IO3)4
AuNO3
Ag2SO4
Ba3(PO4)2
AlH3
FeBr2
KOH
H2S
HCl
II. Escribe la fórmula de los siguientes compuestos:
Sulfito de calcio
Cloruro de magnesio
Carbonato de Níquel III
Bromato de oro III
Cianuro de sodio
Clorato de Manganeso IV
Óxido de estaño II
Carbonato de potasio
Hidróxido de aluminio
III. Utilizando el método de óxido-reducción, balancea las siguientes ecuaciones químicas:
Br2 + KOH → KBr + KBrO3 + H2O
Bi2O3 + NaOH + NaClO → NaBiO3 + NaCl + H2O
I2 + HNO3 → HIO3 + NO2 + H2 O
Ca3(PO4)2 + SiO2 + C → CaSiO3 + P4 + CO
Cl2 + KOH → KClO3 + KCl + H2O
C + HNO3 → CO2 + NO2 + H2O
IV. Elige la opción que responda correctamente:
1. ¿Cuáles son los coeficientes para ajustar correctamente la siguiente ecuación química?
Al + O2 ---> Al2O3
a) 1, 1, 1
b) 2, 3, 2
c) 4, 3, 2
d) 2, 1 1
2. ¿Con cuáles coeficientes se ajusta correctamente la siguiente ecuación química?: C3H8 + O2 ---> CO2 + H2O
a) 1, 5, 3, 4
b) 1, 3, 5, 4
c) 1, 4, 4, 3
d) 1, 3, 4, 5
3. En el compuesto PbO2, el plomo presenta un número de oxidación igual a:
e) -1
f) +2
g) +4
h) -2
4. ¿Cuál es el número de oxidación para el elemento central del compuesto Al(NO3)3?
a) +3
b) +5
c) -2
d) 0
5. La combustión del magnesio se representa de la siguiente manera:
2Mg + O2 ---> 2MgO
¿Cuál o cuáles de las siguientes afirmaciones son verdaderas?
1. El magnesio cambia su número de oxidación de 0 a +2.
2. El oxígeno pierde dos electrones.
3. El oxígeno es el agente oxidante
4. El magnesio es el agente reductor
a) 1, 2 y 3
b) 2 y 4
c) 1, 3 y 4
d) 1 y 3
6. Para la siguiente reacción:
4Fe(s) + 3O2(g) ---> 2Fe2O3(s)
¿Cuál es el valor de AHr°?
a) -1644 kJ
b) -822 kJ
c) -267 kJ
d) 822 kJ
7. De los siguientes enunciados todos son verdaderos, EXCEPTO:
a) Las reacciones endotérmicas tienen una AH positiva.
b) En una reacción endotérmica el calor de reacción es un producto.
c) Las reacciones exotérmicas tienen una AH negativa.
d) Los elementos en su estado basal tienen una AH = 0
8. Para la siguiente reacción:
H2SO4(ac) + 2NaOH(ac) ---> Na2SO4(s) + 2H2O(l) ¿Cuáles enunciados son verdaderos?
1. Es una reacción exotérmica
2. Es una reacción endotérmica
3. Es una reacción de doble sustitución
4. Su DHr° = -244 kJ
a) 1, 3 y 4
b) 2, 3 y 4
c) 1 y 3
d) 2 y 3
9. Se le llama «velocidad de reacción» a:
a) la rapidez con la que se forman los reactivos.
b) La tasa de cambio de los productos.
c) La rapidez con la que se forman los productos.
d) La velocidad de desaparición de los productos.
10. Además de la temperatura y la concentración de los reactivos, ¿Qué otro factor influye en la velocidad de reacción?
a) La presión.
b) El volumen.
c) El catalizador
d) El estado de agregación de los reactivos.
11. ¿Cuál o cuáles de las siguientes afirmaciones está implicada en los efectos del calentamiento global?
1. La aparición de lluvias torrenciales, tormentas, ciclones y huracanes.
2. Extensas sequías y temperaturas extremosas.
3. Aumento de la producción agrícola y ganadera por el aumento en las lluvias.
4. El deshielo paulatino de los polos glaciares.
i) 1, 2 y 3
j) 1, 3 y 4
k) 2, 3 y 4
l) 1, 2 y 4
*La resolución de la guía es OPCIONAL
*Si decides resolverla, deberá estar COMPLETAMENTE contestada y deberás entregarla antes del examen. (Se tomará en cuenta la limpieza y presentación de la guia)
*El valor de la guía será de un 20% de la calificación del examen. En otras palabras, el valor de la guía resuelta dependerá de la calificación que obtengas en el examen.
I. Escribe el nombre de las siguientes fórmulas:
RaF2
Mn(IO3)4
AuNO3
Ag2SO4
Ba3(PO4)2
AlH3
FeBr2
KOH
H2S
HCl
II. Escribe la fórmula de los siguientes compuestos:
Sulfito de calcio
Cloruro de magnesio
Carbonato de Níquel III
Bromato de oro III
Cianuro de sodio
Clorato de Manganeso IV
Óxido de estaño II
Carbonato de potasio
Hidróxido de aluminio
III. Utilizando el método de óxido-reducción, balancea las siguientes ecuaciones químicas:
Br2 + KOH → KBr + KBrO3 + H2O
Bi2O3 + NaOH + NaClO → NaBiO3 + NaCl + H2O
I2 + HNO3 → HIO3 + NO2 + H2 O
Ca3(PO4)2 + SiO2 + C → CaSiO3 + P4 + CO
Cl2 + KOH → KClO3 + KCl + H2O
C + HNO3 → CO2 + NO2 + H2O
IV. Elige la opción que responda correctamente:
1. ¿Cuáles son los coeficientes para ajustar correctamente la siguiente ecuación química?
Al + O2 ---> Al2O3
a) 1, 1, 1
b) 2, 3, 2
c) 4, 3, 2
d) 2, 1 1
2. ¿Con cuáles coeficientes se ajusta correctamente la siguiente ecuación química?: C3H8 + O2 ---> CO2 + H2O
a) 1, 5, 3, 4
b) 1, 3, 5, 4
c) 1, 4, 4, 3
d) 1, 3, 4, 5
3. En el compuesto PbO2, el plomo presenta un número de oxidación igual a:
e) -1
f) +2
g) +4
h) -2
4. ¿Cuál es el número de oxidación para el elemento central del compuesto Al(NO3)3?
a) +3
b) +5
c) -2
d) 0
5. La combustión del magnesio se representa de la siguiente manera:
2Mg + O2 ---> 2MgO
¿Cuál o cuáles de las siguientes afirmaciones son verdaderas?
1. El magnesio cambia su número de oxidación de 0 a +2.
2. El oxígeno pierde dos electrones.
3. El oxígeno es el agente oxidante
4. El magnesio es el agente reductor
a) 1, 2 y 3
b) 2 y 4
c) 1, 3 y 4
d) 1 y 3
6. Para la siguiente reacción:
4Fe(s) + 3O2(g) ---> 2Fe2O3(s)
¿Cuál es el valor de AHr°?
a) -1644 kJ
b) -822 kJ
c) -267 kJ
d) 822 kJ
7. De los siguientes enunciados todos son verdaderos, EXCEPTO:
a) Las reacciones endotérmicas tienen una AH positiva.
b) En una reacción endotérmica el calor de reacción es un producto.
c) Las reacciones exotérmicas tienen una AH negativa.
d) Los elementos en su estado basal tienen una AH = 0
8. Para la siguiente reacción:
H2SO4(ac) + 2NaOH(ac) ---> Na2SO4(s) + 2H2O(l) ¿Cuáles enunciados son verdaderos?
1. Es una reacción exotérmica
2. Es una reacción endotérmica
3. Es una reacción de doble sustitución
4. Su DHr° = -244 kJ
a) 1, 3 y 4
b) 2, 3 y 4
c) 1 y 3
d) 2 y 3
9. Se le llama «velocidad de reacción» a:
a) la rapidez con la que se forman los reactivos.
b) La tasa de cambio de los productos.
c) La rapidez con la que se forman los productos.
d) La velocidad de desaparición de los productos.
10. Además de la temperatura y la concentración de los reactivos, ¿Qué otro factor influye en la velocidad de reacción?
a) La presión.
b) El volumen.
c) El catalizador
d) El estado de agregación de los reactivos.
11. ¿Cuál o cuáles de las siguientes afirmaciones está implicada en los efectos del calentamiento global?
1. La aparición de lluvias torrenciales, tormentas, ciclones y huracanes.
2. Extensas sequías y temperaturas extremosas.
3. Aumento de la producción agrícola y ganadera por el aumento en las lluvias.
4. El deshielo paulatino de los polos glaciares.
i) 1, 2 y 3
j) 1, 3 y 4
k) 2, 3 y 4
l) 1, 2 y 4
Subscribe to:
Posts (Atom)